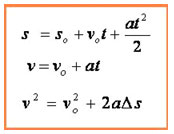01. (UECE 98.1) Uma bomba de bicicleta tem um
comprimento de 24 cm e está acoplada a um pneumático. Inicialmente, o pistão
está recuado e a pressão do ar no interior da bomba é 1,0 atm. É preciso
avançar o pistão de 8,0 cm, para que a válvula do pneumático seja aberta.
Quando isso ocorrer, a pressão, em atm, na câmara de ar, supondo que a
temperatura foi mantida constante, será:
a) 1,5 b) 2,0 c) 2,5 d) 3,0
RESOLUÇÃO:
(Obs.: V = A.h)
P1.V1/T1 = P2.V2/T2 → 1.24.A = (24 – 8).A.P2 → P2 = 24/16 = 3/2 = 1,5 atm.
02. (FUVEST - 2000) Um botijão de gás de
cozinha contém 13 kg de gás liquefeito, a alta pressão. Um mol desse gás tem
massa de, aproximadamente, 52 g. Se todo o conteúdo do bujão fosse utilizado
para encher um balão, à pressão atmosférica e à temperatura de 300 K, o volume
final do balão seria aproximadamente de:
a) 13 m3 b) 6,2 m3 c)3,1 m3 d) 0,98 m3 e) 0,27 m3
Dados: R = 8,3 J/(mol.K)
ou
Dados: R = 0,082
atm.L/(mol.K)
Dados: Patmosférica = 1 atm = 1.105 Pa
Dados: 1
Pa = 1 N/m2
Dados: 1 m3 = 1000 L
RESOLUÇÃO:
p.V = n.R.T, vem:
p.V = (m/M).R.T => 1x105.V =
(13000/52).8,3.300 => V ≅ 6,2 m3
03. (ITA - 2000) O ar dentro de um automóvel fechado tem
massa de 2.6kg e calor especifico de 720 J/kg °C. Considere que o motorista
perde calor a uma taxa constante de 120 joules por segundo e que o aquecimento do
ar confinado se deva exclusivamente ao calor emanado pelo motorista. Quanto
tempo levara para a temperatura variar de 2.4°C a 37°C?
a) 540s b)420s c)300s d)480s e)360s
RESOLUÇÃO:
Q = mc ΔT
aonde Q é o calor fornecido pelo motorista ao ar
m é a massa do ar
c é o calor específico do ar
ΔT é a variação da temperatura do ar.
Dados do enunciado:
m = 2,6 Kg
c = 720 J/Kg °C
ΔT = Tf - Ti = 37°C - 2,4°C = 34,6
substituindo em
Q = mc ΔT
temos
Q = 2,6 * 720 * 34,6
Q = 720 * 89,96
Q = 64771,2 J
Usando que o fluxo de calor φ é dado por
φ = Q / Δt
dados:
Q = 64771,2 J (acabamos de obter)
φ = 120 J/s (taxa na qual o motorista perde calor)
Assim
φ = Q / Δt
120 = 64771,2 / Δt
Δt = 64771,2 / 120
Δt = 539,76 s
Δt ≈ 540s
04. (UERJ) Uma menina deseja fazer um chá de camomila, mas só
possui 200 gramas de gelo a 0 °C e um forno de micro-ondas, cuja potência máxima
é de 800W. Considere que a menina está ao nível do mar, o calor latente de
fusão do gelo é 80 cal/g, o calor específico da água vale 1 cal/(g. °C) e que 1
caloria vale aproximadamente 4 joules. Usando esse forno sempre na potência
máxima, o tempo necessário para a água entrar em ebulição é:
a)45s b)90S C)180s d)360s
RESOLUÇÃO:
Primeiramente
calcula-se o calor necessário para transformar gelo em água:
Q = M.L
Q=200×80
Q=16.000 cal.
Agora calcula-se o
calor para fazer entrar em ebulição (100 graus Celsius) (água líquida de 0
graus até 100 graus), usa:
Q=M·C· (Tf-Ti)
Q=200·1· (100-0)
Q=20.000 cal.
Como potência é energia sobre tempo e no sistema internacional energia e dado
joule, potência em Watts, e tempo em segundos…
Energia: (20.000 + 16.000)
x 4 = 144.000 JOULES
Potencia: 800W
Logo 144.000 = 800/t
t = 180 segundos
05. Um
gás ideal sofre a transformação A → B → C indicada no diagrama.
O
trabalho realizado pelo gás nessa transformação, em joules, vale:
a)
2,0.106 b) 1,5.106 c) 1,2.106 d) -1,5.106 e) -1,2.106
RESOLUÇÃO:
WABC = WAB + WBC = (5 – 2).5.105 + 0 = 15.105 = 1,5.106
J.
06. Numa montagem, a chama faz o pistão deslocar-se para a
direita, mantendo o gás a pressão e temperatura constantes. O volume e a
pressão iniciais eram, respectivamente, de 5,00 litros e 5,00 N/m2.
O volume foi aumentado para 7,50 litros. A fração de energia da chama que o gás
converteu em energia mecânica é, em J, igual a:
a)
375 b) 125 c) 37,5 d) 25,0 e) 12,5
RESOLUÇÃO:
A pressão está em Pa (N/m²) e o volume está em litros. Veja que:
1L = 0,001 m3
2,5 L = 0,0025 m3
Logo, a variação de volume é 2,5.10-3 m³.
O trabalho realizado é:
P·ΔV = 5 x é 2,5.10-3 = 12,5.10-³ J = 0,0125 J
07. (Mackenzie-SP) Sobre um sistema, realiza-se um trabalho
de 3000 J e, em resposta, ele fornece 500 cal ao meio exterior durante o mesmo
intervalo de tempo. Se cal = 4,18 J Determine a variação da energia do sistema.
a)
2000 J b) 900 J c) -2100 J d) -990 J e) 2100 J
RESOLUÇÃO
Primeiro transformamos um dos valores de forma que fiquem na mesma
unidade:
1 cal ----------- 4,2
500cal -------- x
x = 2100 J
Trabalho recebido
é negativo.
Calor
cedido é negativo.
Agora aplicamos na fórmula abaixo:
ΔU= Q - T(trabalho) ou ΔU= Q – W
ΔU= - 2100 - (- 3000)
ΔU= 900 J
08.
(UFES) A figura mostra a variação do volume de um gás ideal, à pressão
constante de 4 N/m2, em função da temperatura. Sabe-se que, durante a
transformação de estado de A a B, o gás recebeu uma quantidade de calor igual a
20 joules. A variação da energia interna do gás entre os estados A e B foi de:
a) 4 J b) 16 J c) 24 J d) 380 J e) 420 J
RESOLUÇÃO:
I. W = P.ΔV = 4.(2 – 1) = 4 J.
II. ΔU = Q – W =
20 – 4 = 16 J.
09. (UEL-PR) Fornecem-se 5,0 calorias de energia
sob forma de calor a um sistema termodinâmico, enquanto se realiza sobre ele
trabalho de 13 joules. Nessa transformação, a variação de energia interna do
sistema é, em joules: (Dado: 1,0 cal = 4,2 J)
a) -8 b) 8 c) 13 d) 21 e) 34
RESOLUÇÃO:
ΔU = Q –W
= 21 – 13 = 8 J
10. (PEIES 97) Um gás ideal sofre uma expansão adiabática.
Então, o gás _________ energia na forma de calor com a vizinhança, e a sua
temperatura final é _________ inicial.
Assinale a alternativa que completa,
corretamente, as lacunas.
a) não troca – menor que a
b) não troca – maior que a
c) não troca – a mesma
d) troca – menor que a
e) troca – maior que a
11.(UFRGS - 1997) Um recipiente contém um gás
ideal à temperatura T. As moléculas deste gás têm massa m e velocidade
quadrática média v. Um outro recipiente contém também um gás ideal, cujas
moléculas têm massa 3m e a mesma velocidade quadrática média v. De acordo com a
teoria cinética dos gases, qual é a temperatura deste segundo gás?
a)T/9
b)T/3 c)T d)3T 9T
RESOLUÇÃO
Energia cinética média = m v2 / 2 = 3 k
T / 2 (k é constante de Boltzmann)
Então, temperatura é diretamente proporcional à
massa molecular.
m ==> T
3m ==> 3T
12. Misturam-se 625g de gelo a 0ºC com 1000g de água a 50ºC
em um calorímetro de capacidade térmica desprezível. A temperatura de equilíbrio
da mistura resultante, em ºC será, aproximadamente, igual a: (DADOS: calor especifico da água= 1,0
cal/g.ºC; calor latente de fusão do gelo= Lf= 80cal/g)
a) 10 b)
18 c) 27 d) 38 e) 0
RESOLUÇÃO
Q1 = 1000.1.50 >> 50 000 cal [água fornece]
Q2 = 625.80 >> 50 000 cal [gelo se fundir]
Temperatura final, ou de equilíbrio >> 0ºC
13. (MACK) Certa massa de gás ideal sofre uma transformação
na qual sua energia interna não varia. Essa transformação é:
a) isotérmica
b) isobárica
c) isométrica
d) adiabática
e) inexistente