A isomeria geométrica ou cis-trans ocorre em
compostos de cadeia aberta com pelo menos uma ligação dupla entre
carbonos que possuam os ligantes diferentes entre si.
A isomeria espacial ou estereoisomeria
ocorre quando temos dois compostos com mesma fórmula molecular, mas que
se diferenciam pelo arranjo espacial de seus átomos. Não é possível ver a
diferença entre esses isômeros somente analisando a fórmula estrutural
plana, porque eles possuem o mesmo tipo de cadeia carbônica, o mesmo
grupo funcional, a mesma insaturação e o mesmo substituinte ou
heteroátomo.
Esses isômeros, chamados
de estereoisômeros, podem ser diastereoisômeros ou enantiômeros. A
isomeria espacial do tipo geométrica, também chamada de cis-trans, ocorre com os diastereoisômeros, que são isômeros que não são a imagem especular um do outro.
A
isomeria geométrica ocorre especialmente em compostos de cadeia aberta
que possuem ligação dupla entre pelo menos dois átomos de carbono, sendo
que cada átomo de carbono da dupla possui os seus grupos ligados
diferentes entre si.
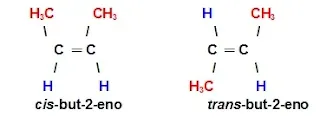
Vejamos um exemplo para entender como esse tipo de isomeria espacial ocorre: Considere os dois isômeros formados pelo but-2-eno:
Temos que:
A dupla ligação entre os carbonos é
rígida, ou seja, não é passível de sofrer rotação e de ser a mesma
molécula, mas sim corresponde a compostos diferentes. É por isso que a
isomeria geométrica não ocorre em compostos de cadeia aberta que sejam
saturados, isto é, que possuam somente ligações simples entre os
carbonos, tendo em vista que essas ligações podem sofrer rotação e
serem, na verdade, somente um composto orgânico.

Em compostos que possuem ligações triplas
entre os carbonos, a isomeria geométrica também não ocorre, porque tais
átomos só podem realizar mais uma ligação, visto que já possuem três.
Além
disso, os dois grupos ligantes de cada carbono da insaturação devem ser
diferentes, pois, conforme os exemplos abaixo mostram, se houver só um
grupo diferenciado, a isomeria geométrica não ocorre:
Exemplos em que a isomeria geométrica não ocorre:
Os
isômeros geométricos possuem diferentes propriedades químicas e
físicas. Por exemplo, o ácido butenodioico possui dois isômeros (cis e trans), mostrados abaixo:
Conformações cis-trans do ácido maleico e do fumárico
Veja que o ácido maleico é o isômero cis
porque os dois grupos hidroxila (OH) estão no mesmo plano. Em razão
dessa conformação, esse ácido é capaz de sofrer desidratação
intramolecular e é um composto tóxico.
Já
o ácido fumárico possui os dois grupos hidroxila (OH) em planos
opostos, não sendo capaz de fazê-los interagir e, em razão do
impedimento espacial, ele não sofre desidratação intramolecular. Além
disso, o ácido fumárico não é tóxico, mas é natural ao corpo humano e é
usado em tratamentos de pele, tais como tratamentos contra acne. Ele
está presente na planta fumária (Fumaria officinalis) mostrada no início do texto.
A isomeria geométrica (cis-trans) também ocorre em compostos de cadeia fechada, desde que existam no ciclo dois átomos de carbono com dois grupos diferentes, como mostrado a seguir:
Fórmula dos isômeros 1,2-dimetilciclobutano
Fonte: Manual da Química
Autora:
Jennifer Rocha Vargas Fogaça
-
Graduada em Química
![]() Curta nossa Fan Page no Facebook: https://www.facebook.com/SuperReforco
Curta nossa Fan Page no Facebook: https://www.facebook.com/SuperReforco